Axit Sunfuric là một cái tên quen thuộc đối với mọi người khi còn trong ghế nhà trường. Axit Sunfuric đã được mệnh danh là “Vua của các hóa chất” vì có vai trò cũng như là chất cần thiết, quan trọng trong nhiều ứng dụng đối với con người phục vụ đời sống. Bên cạnh đó Axit Sunfuric còn gây nhiều phiền toái và rất nguy hiểm nếu không sử dụng đúng cách. Hãy cùng mình tìm hiểu về chất này qua bài viết này nhé.
Axit sunfuric là gì?
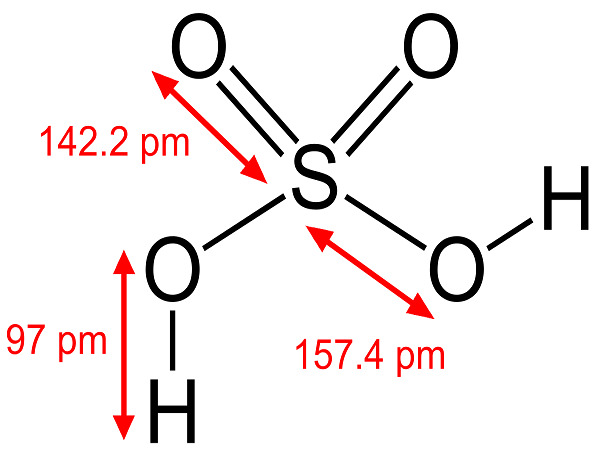
Axit sunfuric là một axit vô cơ phổ biến nhất, gồm các nguyên tố lưu huỳnh (S), oxy (O) và hydro (H). Công thức hóa học của nó là H2SO4. Nó có tên tiếng anh Acid Sulfuric, ngoài ra còn có tên khác như là dầu Sulfate và Hydro sulfate.
Tính chất vật lí của H2SO4
Axit sunfuric là chất lỏng sánh như dầu. Nó không màu, không mùi và sánh, tan vô hạn trong nước. H2SO4 là chất rất háo nước, khi phản ứng xảy ra sẽ tỏa một lượng nhiệt cao. Tan nhiều trong hầu hết các dung môi hữu cơ. H2SO4 có khả năng làm than hóa các hợp chất hữu cơ.
Nhiệt độ sôi là 336 °C và Độ nóng chảy 10.371°C.
Tính chất hóa học của H2SO4
Axit Sunfuric có tính axit rất mạnh, tính bào mòn của chúng cũng đáng kể. Có thể gây nguy hiểm cho bất cứ thứ gì mà nó chạm nào nếu vượt nồng độ cho phép, hay nồng độ cao.
H2SO4 có độ biến động rất thấp nên đóng vai trò quan trọng trong việc điều chế các axit dễ bay hơi hơn từ các muối aixt khác. Ngoài ra hóa chất này được sử dụng để làm khô nhiều loại khí không phản ứng với axit vì tính háo nước của mình
Vì có tính axit, chúng cũng có thể làm quỳ tím hóa đỏ.
Axit Sunfuric có hai loại: đặc và loãng
Tính chất H2SO4 loãng
- H2SO4 + kim loại (đứng trước H, trừ Pb) -> muối sunfat:
Fe + H2SO4 → FeSO4 + H2↑
- Tác dụng với oxit bazơ tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric + bazơ -> muối mới + nước
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 + muối -> muối mới + axit mới
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2↑
Ở hai phương trình trên, axit mới là HCO3, vì đây là một axit yếu nên khi vừa sinh ra nó lại nhanh chóng trở thành H2O + CO2
Tính chất với H2SO4 đặc
- H2SO4 + kim loại -> muối sunfat + chất khử + nước
Ví dụ: Khi cho mảnh đồng (Cu) vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí mùi sốc thoát ra.
Cu + 2H2SO4 → CuSO4 + SO2 ↑ + 2H2O
- H2SO4 + phi kim -> oxit phi kim + nước, giải phóng khí SO2
C + 2H2SO4 → CO2 + 2H2O + 2SO2↑ (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2↑ + 2H2O
- Ngoài ra, H2SO4 còn phản ứng với một số chất khử khác:
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- Khi cho H2SO4 vào cốc đựng đường, đường sẽ dần có màu đen và phun trào:
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
Ngoài ra, nhiệt độ có trong H2SO4 cũng đóng vai trò quan trọng trong các phản ứng của nó. Ví dụ điển hình như, H2SO4 đặc nguội không có phản ứng với sắt (Fe) hay nhôm (Al), nhưng đặc nóng thì lại phản ứng.
Sự phân cực và độ dẫn điện của H2SO4
H2SO4 nguyên chất sẽ có hệ số điện môi xấp xỉ 100, là một chất phân cực. Các phân tử của axit sunfutic có khả năng proton hóa lẫn nhau, làm nên tính dẫn điện cực, quá trình này gọi là tự di chuyển proton.
Những lưu ý về Axit Sunfuric (H2SO4):
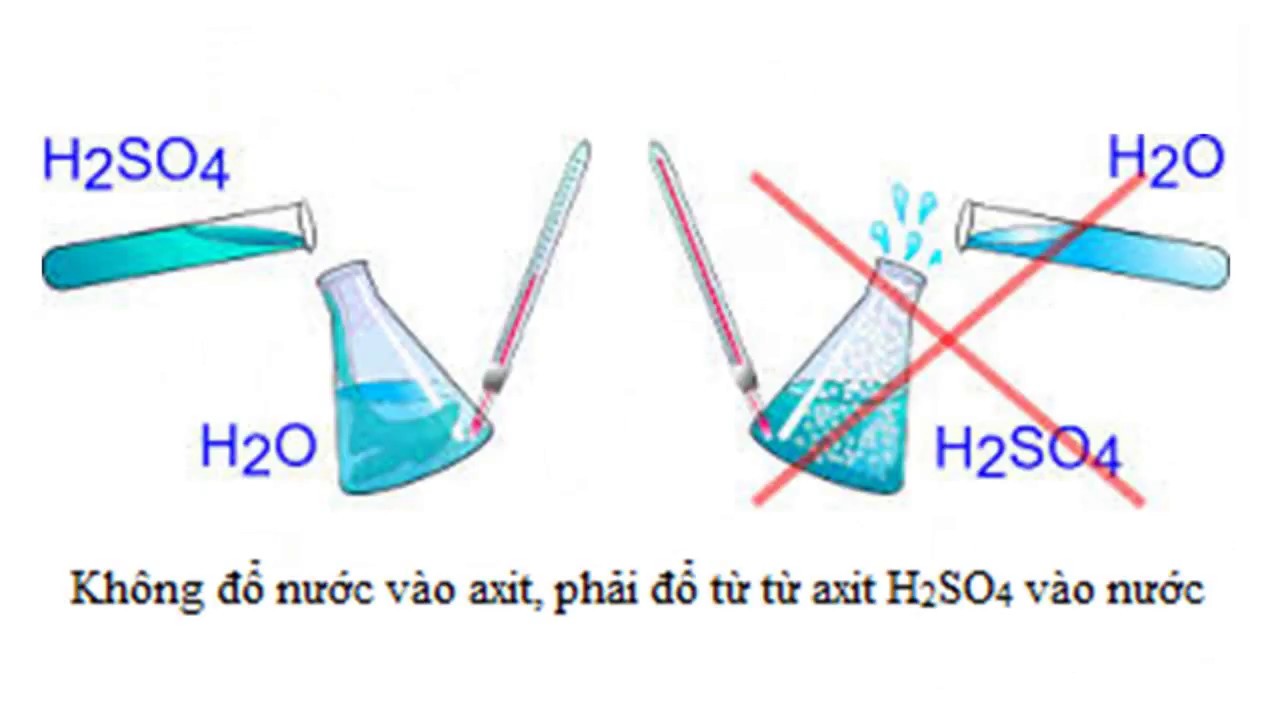
Như các bạn đã biết, H2SO4 là một trong những axit vô cơ rất mạnh, nên tính bào mòn của chúng rất đáng kể. Khi để Axit Sunfuric với một nồng độ đáng kể (thậm chí khi ở nồng độ đậm đặc 98%) có thể gây bỏng nặng, bắn vào mắt có thể mù, rơi vào giấy, vải sẽ bị cháy… Vì thế nên có sự chuẩn bị kĩ càng trong khâu chế các phản ứng hóa học đối với lọai axit này.
Với tính chất háo nước của mình, khi gặp nước H2SO4 sẽ phản ứng ngay lập tức và rất nhanh, bên cạnh đó còn tỏa một lượng nhiệt đáng kể. Chính vì lý do này, khi điều chế phản ứng này, chỉ được đổ từ từ H2SO4 vào trong nước, tuyệt đối không được làm ngược lại.
Điều này dễ hiểu khi ta đổ một lần lượng lớn sẽ gây tỏa nhiệt rất lớn hơn bình thường. Và nếu làm ngược lại, các hóa chất sẽ tung tóe và bắn ra ngoài, còn nguy cơ gây nổ. Cả hai đều gây tổn thương, có thể gây chết người ở xung quanh đó.
Đun sôi H2SO4 có thể sản xuất ra khí SO2, SO3. Đây là hai khí gây độc và chết người.
Tuyệt đối không được để axit chảy vào hệ thống thoát nước. Không được ngửi hoặc hít hóa chất. Không được để axit tràn ra ngoài.
Những ứng dụng của H2SO4 mang lại cho con người
Dù rất có nhiều tác hại, nguy hiểm cho con người. Nhưng vẫn không thể phủ nhận việc những lợi ích mà H2SO4 mang lại rất nhiều.
-
Trong các ngành công nghiệp
Axit sunfuric đóng vai trò trong hàng loạt các quá trình sản xuất kim loại (đồng, kẽm,…) và là nguyên liệu của một số dung dịch dung dịch tẩy gỉ, làm sạch bề mặt thép,…
Sử dụng để sản xuất nhôm sunfat (VD: phèn làm giấy). Chất quan trọng trong quá trình sản xuất các loại muối sunfat, tẩy rửa kim loại trước khi mạ, chế tạo thuốc nổ, chất dẻo, thuốc nhuộm, sản xuất dược phẩm,…
Hỗn hợp axit với nước còn được dung làm chất điện giải trong hàng loạt các dạng ắc quy, axit chì…
Ngoài ra còn có mặt trong các ngành công nghiệp như phân bón, luyện kim, phấn nhuộm, chết dẻo, giấy, sợi,…
-
Xử lí chất thải
Dùng để sản xuất nhôm hidroxit (AlOH3), đây là chất được sử dụng để lọc các tạp chất, cải thiện mùi vị của nước, trung hòa độ pH của nước, và loại bỏ tình trạng nước cứng (các ion Mg2+, Ca2+) có trong nước thải.
-
Sản xuất phân bón
Dùng trong quá trình tạo ra axit photphoric – loại chất được sử dụng để sản xuất các loại phân photphat, hay Amoni sunfat.
-
Quá trình lọc dầu
Sử dụng một axit làm chất xúc tác kết hợp với H2SO4 thường được để loại bỏ các hợp chất của lưu huỳnh (S) và hydrocacbon không bão hòa có trong dầu thô. Một trong những phương pháp lọc dầu khá phổ biến.
-
Áp dụng vào y học
Một trong những ứng dụng của H2SO4 trong y học chính là chế tạo hóa trị kìm hóa chống và ngăn ngừa ung thư.
-
Sản xuất ắc quy chì
Axit sunfuric khi ở dạng loãng được áp dụng để hoạt động như một chất điện phân để liên kết các phần pin với nhau. Ở cách này H2SO4 được gọi là Pin axit.
Và nhiều ứng dụng khác…
Một số cách bảo quản Axit Sunfuric
Sử dụng bồn nhựa, phuy nhựa để chứa Axit Sunfuric. Tuyệt đối không dùng các bồn bằng nhôm, thiết, inox, kẽm,… Vì H2SO4 có đặc tính ăn mòn rất mạnh.
Nếu chứa H2SO4 bằng các bồn sắt đều phải bắt buộc tráng lớp PU . Đậy nắp kín, đặt nơi khô ráo. Tránh xa nơi có chứa các chất có thể phản ứng với nó như bazơ hay các chất khử. Tránh để gần các kim loại, kim loại nhẹ, các chất có tính axit vì có khả năng gây nổ lớn.
Điều chế Axit sunfuric như nào?
Trước khi nói đến phương pháp điều chế Axit sunfuric. Tôi khuyên các bạn không nên tự tiện điều chế chúng, làm tại nhà.
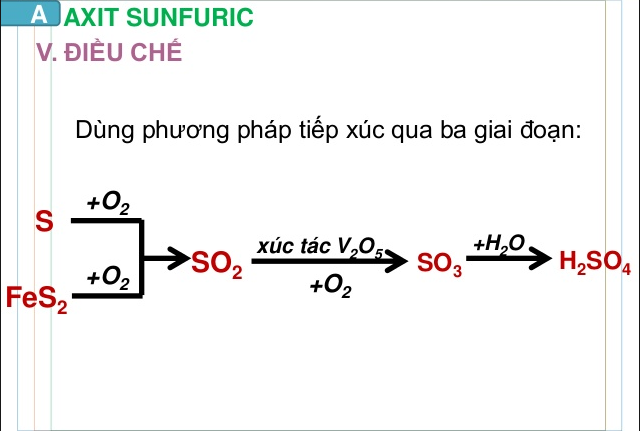
Có thể theo chu trình như sau: FeS2 hoặc S → SO2 → SO3 → H2SO4
– Đốt cháy quặng firit sắt:
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
– Oxi hóa SO2 bằng oxi trong điều kiện 400 – 5000C, xúc tác V2O5):
2SO2 + O2 → 8SO3
– Axit sunfuric đặc hấp thụ SO3 tạo thành oleum có công thức tổng quát là H2SO4.nSO3:
nSO3 + H2SO4 → H2SO4 .nSO3
– Pha loãng oleum thành axit sunfuric bằng lượng nước thích hợp:
H2SO4 .nSO3 + (n+1) H2O→ (n+1)H2SO4
Vậy chúng ta đã tìm hiểu về H2SO4. Hi vọng qua bài viết trên, có thể giúp các bạn hiểu được phần nào về Axit sunfuric.
Nguồn https://huthamcauthongcongnghet.net/





